Hoje vou dedicar um post a um tipo de interação fraca que
muitas vezes é desprezada nas aulas de química (provavelmente por serem mais
fracas do que as ligações covalentes…), mas que na bioquímica são tanto ou mais
importantes do que as ligações covalentes. Estou a falar das interações (ou ligações) não covalentes.
Antes de começar a falar delas convém destacar qual a diferença entre as
ligações não covalentes e as covalentes. Nas primeiras não existe partilha de
eletrões entre os átomos participantes na ligação, enquanto que na segunda
existe partilha dos mesmos (eletrões ligantes). Como não existe partilha de
eletrões, a ligação resultante é significativamente mais fraca.
Existem diferentes tipos de interações não covalentes que,
coletivamente, são designadas de forças de van der Waals. Os principais tipos
são:
- interação iónica
- interação dipolo-dipolo
- interação dipolo-ião
- ligação de hidrogénio
- forças de dispersão de London
 Muitas vezes estas interações são designadas de forças
intermoleculares, ou seja, forças que existem entre moléculas. De facto, é a
existência deste tipo de interações que permite que as moléculas interatuem
umas com as outras, justificando assim a existência de substâncias no estado
líquido ou sólido. Apesar de todas as forças intermoleculares serem deste tipo,
elas são também muitas vezes responsáveis por interações que ocorrem entre
diferentes regiões dentro de uma molécula, sendo então designadas de forças
intramoleculares. Esta situação é particularmente frequente no caso da
bioquímica, onde lidamos frequentemente com macromoléculas, ou seja, com
moléculas grandes. Portanto, as ligações não-covalentes podem ser intra- ou
intermoleculares.
Muitas vezes estas interações são designadas de forças
intermoleculares, ou seja, forças que existem entre moléculas. De facto, é a
existência deste tipo de interações que permite que as moléculas interatuem
umas com as outras, justificando assim a existência de substâncias no estado
líquido ou sólido. Apesar de todas as forças intermoleculares serem deste tipo,
elas são também muitas vezes responsáveis por interações que ocorrem entre
diferentes regiões dentro de uma molécula, sendo então designadas de forças
intramoleculares. Esta situação é particularmente frequente no caso da
bioquímica, onde lidamos frequentemente com macromoléculas, ou seja, com
moléculas grandes. Portanto, as ligações não-covalentes podem ser intra- ou
intermoleculares.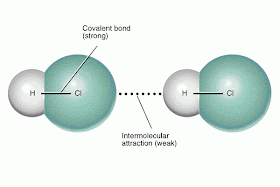

Muito bom!
ResponderEliminarObrigado pelo comentário Allan Allen! :)
EliminarMuito bom!
ResponderEliminarBastante explicativo!
ResponderEliminarObrigado! :)
EliminarMais explicativo impossível!
ResponderEliminarObrigado Luana! :)
EliminarMuito bem explicado os assuntos referentes a matéria
ResponderEliminarObrigado, volta sempre! :)
EliminarBacana a iniciativa. Mas quando você fala de interação iônica, está dizendo em relação ao íon de um composto que interage com o íon de outro composto, correto? Pergunto isso, pois nas aulas de química geral, aprendemos que a ligação iônica (como ocorre no cloreto de sódio) é bastante forte (parecido com a covalente). Obrigado pela atenção!
ResponderEliminar