Numa altura em que os testes genéticos estão cada vez mais na moda, aqui fica uma perspetiva diferente da análise ao DNA. :)
Este blogue tem como objectivo divulgar conceitos, informações, músicas, vídeos, jogos, cartoons, curiosidades, sobre temas relacionados com a bioquímica. Porque a Bioquímica não tem que ser incompreensível...
Páginas
▼
sexta-feira, 30 de junho de 2017
quarta-feira, 28 de junho de 2017
Fosfofrutocinase 1
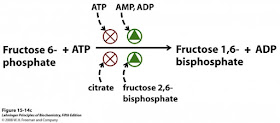
 A fosfofrutocinase 1, também conhecida como PFK-1, é a segunda enzima regulatória da glicólise e o seu principal ponto de regulação. É uma enzima alostérica pertencente à família das fosfotransferases que catalisa uma fosforilação: a conversão de frutose-6-fosfato e ATP em frutose-1,6-bisfosfato e ADP, um passo chave na regulação e limitação da taxa de glicólise, em resposta às necessidades energéticas da célula, através do processo de inibição alostérica.A regulação alostérica é a forma mais rápida de regulação específica de determinadas enzimas – as enzimas regulatórias. Requer a presença de moléculas, os moduladores alostéricos, que interatuam com as enzimas, conduzindo a alterações estruturais, tornando a enzima ou mais rápida (moduladores positivos) ou mais lenta (moduladores negativos).
A fosfofrutocinase 1, também conhecida como PFK-1, é a segunda enzima regulatória da glicólise e o seu principal ponto de regulação. É uma enzima alostérica pertencente à família das fosfotransferases que catalisa uma fosforilação: a conversão de frutose-6-fosfato e ATP em frutose-1,6-bisfosfato e ADP, um passo chave na regulação e limitação da taxa de glicólise, em resposta às necessidades energéticas da célula, através do processo de inibição alostérica.A regulação alostérica é a forma mais rápida de regulação específica de determinadas enzimas – as enzimas regulatórias. Requer a presença de moléculas, os moduladores alostéricos, que interatuam com as enzimas, conduzindo a alterações estruturais, tornando a enzima ou mais rápida (moduladores positivos) ou mais lenta (moduladores negativos).
A nível estrutural, apresenta-se como um homotetrâmero, ou seja, é constituída por 4 subunidades. A PFK-1 pode ser composta por três tipos de formas: M, L ou P, dependendo do tipo de tecido em que se encontra. Por exemplo, o músculo expressa apenas a isoenzima M. Já no fígado e rins predomina a isoforma L. Quanto aos eritrócitos expressam ambas as formas M e L.
Cada subunidade deste tetrâmero possui 319 aminoácidos e é composto por dois domínios: um que se liga ao ATP e o outro que se liga à frutose-6-fosfato.
O domínio N-terminal possui um papel de catalisador de ligação de ATP, enquanto que o terminal C apresenta um papel regulador.
A atividade da PFK-1 depende de um mecanismo em que ocorre transição de um estado T enzimaticamente inativo para um estado R ativo. Se, por um lado, a frutose-6-fosfato se liga, com elevada afinidade, ao estado R, já a mudança para o estado T inibe a sua capacidade de se ligar à enzima.
A atividade desta enzima é controlada por ativadores e inibidores. Por um lado, os ativadores podem ser indicadores de défice energético (ADP, AMP), já que a glicólise pretende compensar esse défice; ou o substrato da reação que catalisa (frutose-6-fosfato), entre outros ativadores. Por outro lado, como inibidores existem o ATP, visto que, se a célula já possuir ATP suficiente, faz todo o sentido que a glicólise seja inibida; o produto da reação (frutose-1,6-bisfosfato), assim como todos os intermediários gerados nas reações seguintes; os intermediários do ciclo de Krebs, se houver acumulação destes intermediários, não será necessário continuar o processo de glicólise; o glucagon, dado que, esta hormona é produzida em situações de hipoglicemia e tem como objetivo elevar a concentração de glucose no sangue, não fazendo sentido gastá-la; entre outros inibidores.
Os ativadores alostéricos ligam-se com o objectivo de facilitar a formação do estado R, induzindo alterações estruturais na enzima, já os inibidores ligam-se para facilitar a formação do estado T inibindo, assim, a atividade da enzima.
Cada subunidade deste tetrâmero possui 319 aminoácidos e é composto por dois domínios: um que se liga ao ATP e o outro que se liga à frutose-6-fosfato.
O domínio N-terminal possui um papel de catalisador de ligação de ATP, enquanto que o terminal C apresenta um papel regulador.
A atividade da PFK-1 depende de um mecanismo em que ocorre transição de um estado T enzimaticamente inativo para um estado R ativo. Se, por um lado, a frutose-6-fosfato se liga, com elevada afinidade, ao estado R, já a mudança para o estado T inibe a sua capacidade de se ligar à enzima.
A atividade desta enzima é controlada por ativadores e inibidores. Por um lado, os ativadores podem ser indicadores de défice energético (ADP, AMP), já que a glicólise pretende compensar esse défice; ou o substrato da reação que catalisa (frutose-6-fosfato), entre outros ativadores. Por outro lado, como inibidores existem o ATP, visto que, se a célula já possuir ATP suficiente, faz todo o sentido que a glicólise seja inibida; o produto da reação (frutose-1,6-bisfosfato), assim como todos os intermediários gerados nas reações seguintes; os intermediários do ciclo de Krebs, se houver acumulação destes intermediários, não será necessário continuar o processo de glicólise; o glucagon, dado que, esta hormona é produzida em situações de hipoglicemia e tem como objetivo elevar a concentração de glucose no sangue, não fazendo sentido gastá-la; entre outros inibidores.
Os ativadores alostéricos ligam-se com o objectivo de facilitar a formação do estado R, induzindo alterações estruturais na enzima, já os inibidores ligam-se para facilitar a formação do estado T inibindo, assim, a atividade da enzima.
Texto escrito por:
Ana Maria Araújo
Ana Sofia Oliveira
Maria Sofia Silva
Renata Teixeira
.
segunda-feira, 26 de junho de 2017
sexta-feira, 23 de junho de 2017
Stress oxidativo – principais defesas antioxidantes enzimáticas
Superóxido dismutase (SOD):
Esta enzima, presente em quase todas as células, é uma defesa antioxidante muito importante, que causa a dismutação do anião superóxido em oxigénio e peróxido de hidrogénio. Apresenta várias isoformas (3 no ser humano), que diferem não apenas na sua localização intracelular, mas também no cofator que utilizam. Assim, a forma citosólica utiliza cobre e zinco como cofatores, sendo muitas vezes referida como Cu-Zn-SOD, ou SOD1. A forma mitocondrial utiliza manganês como cofator, sendo referida como Mn-SOD, ou SOD2. A forma extracelular, tal como a SOD1, também utiliza Cu-Zn-SOD, sendo referida como SOD3. A SOD1 é uma enzima dimérica, enquanto que a SOD2 e a SOD3 são tetraméricas. Mutações nos genes que codificam para as diferentes isoformas têm, normalmente, consequências muito graves para os indivíduos, o que revela bem a importância destas enzimas.
Catalase:
Esta enzima, presente nos peroxissomas das nossas células, tem um papel fundamental na dismutação do peróxido de hidrogénio em água e oxigénio (mais informações sobre esta enzima aqui). É uma enzima muito eficiente, e que impede que o peróxido de hidrogénio seja convertido em radicais livres através das reações de Fenton e de Haber-Weiss. É predominantemente tetramérica, utilizando grupos heme com ferro como cofator (um por cadeia polipeptídica).
Glutationa peroxidase:
Esta enzima é muito importante como defesa antioxidante contra peróxidos (orgânicos e inorgânicos). Convém destacar que numa situação de stress oxidativo, muitas vezes as nossas biomoléculas são convertidas em peróxidos. Portanto, esta enzima permite parar a cadeia de propagação de danos oxidativos. A sua atividade catalítica baseia-se na utilização da glutationa, uma molécula composta por 3 aminoácidos, com propriedades antioxidantes. Basicamente a enzima tira partido dessa propriedade, promovendo a oxidação da glutationa e impedindo assim a oxidação de outras biomoléculas. Ou seja, requer a presença de glutationa na forma reduzida, o que, por sua vez, necessita de magnésio e de NADPH.
.
quarta-feira, 21 de junho de 2017
segunda-feira, 19 de junho de 2017
Pepsina
A pepsina foi descoberta por Theodor Schwann em 1835 após ter sido extraída de uma glândula da parede estomacal. Após a descoberta desta enzima, Theodor demonstrou que uma vez misturado com ácido clorídrico (que já era reconhecido como um dos constituintes do suco gástrico) um extrato, preparado a partir de glândulas do tecido estomacal, exibia uma maior capacidade de “dissolver” carne do que o ácido clorídrico sozinho.
 No que toca à sua estrutura, é uma proteína monomérica com elevada percentagem de resíduos ácidos. O peso molecular da pepsina é aproximadamente 34,5 kDa , enquanto o pepsinogénio (precursor da pepsina) ronda os 41,4 kDa. Para a pepsina ser ativa, terá de ser adicionado um protão a um dos dois resíduos de aspartato no centro ativo, e retirado um protão ao outro (isto ocorre entre pH 1 e 5). NOTA: acima de pH 7 a pepsina é irreversivelmente desnaturada.A pepsina é a principal enzima proteolítica ativa secretada pelo suco gástrico, solução aquosa rica em ácido clorídrico e em enzimas que atuam na digestão de proteínas. Existem células especializadas na secreção de ácido clorídrico (células parietais), o que faz com que o ambiente gástrico seja extremamente ácido. Estas células produzem uma enzima gástrica inativada (pepsinogénio) que ao entrar em contato com o HCl transforma-se em pepsina (forma ativa). Este contacto com o HCl é crucial, visto que a pepsina só reage em meio acido.
No que toca à sua estrutura, é uma proteína monomérica com elevada percentagem de resíduos ácidos. O peso molecular da pepsina é aproximadamente 34,5 kDa , enquanto o pepsinogénio (precursor da pepsina) ronda os 41,4 kDa. Para a pepsina ser ativa, terá de ser adicionado um protão a um dos dois resíduos de aspartato no centro ativo, e retirado um protão ao outro (isto ocorre entre pH 1 e 5). NOTA: acima de pH 7 a pepsina é irreversivelmente desnaturada.A pepsina é a principal enzima proteolítica ativa secretada pelo suco gástrico, solução aquosa rica em ácido clorídrico e em enzimas que atuam na digestão de proteínas. Existem células especializadas na secreção de ácido clorídrico (células parietais), o que faz com que o ambiente gástrico seja extremamente ácido. Estas células produzem uma enzima gástrica inativada (pepsinogénio) que ao entrar em contato com o HCl transforma-se em pepsina (forma ativa). Este contacto com o HCl é crucial, visto que a pepsina só reage em meio acido.
O principal ativador da pepsina é o pepsinogénio, enquanto que os seus inibidores são álcoois alifáticos e a pepstatina A.
A pepsina tem a função de digerir proteínas, através da catalisação da hidrolise dessas moléculas quebrando as ligações peptídicas entre alguns aminoácidos, é específica para certos pontos da proteína, e, portanto, não ocorre uma digestão completa. Os produtos dessa quebra são cadeias de aminoácidos relativamente longas, como as peptonas, mas há aminoácidos que se libertam completamente como a fenilalanina, o triptofano e a tirosina principalmente.
A deficiência de pepsina no organismo pode ser causada principalmente por problemas fisiológicos, como a acloridria , deficiência na secreção ácida no estômago, ou resultantes da utilização de certos medicamentos que inibem a secreção de ácido clorídrico no estômago, como os anti-ulcerativos e os antiácidos. Problemas fisiológicos deste tipo impossibilita a conversão do pepsinogénio em pepsina. Esta deficiência acarreta em uma má digestão proteica, facto que pode fazer aumento o tempo de digestão e causar acumulação de proteínas no intestino, causando fermentação (pelas bactérias presentes no intestino) e deficiência na absorção de aminoácidos pelo organismo.
CURIOSIDADES: A pepsina pode ser extraída do estômago de suínos e bovinos e utilizada pela indústria alimentícia na produção de coagulantes de leite e amaciadores de carne. O nome “Pepsi” (marca de refrigerantes) tem esse nome por ter pepsina na sua constituição e, inicialmente, era utilizada como um medicamento para curar a dispepsia.
A pepsina tem a função de digerir proteínas, através da catalisação da hidrolise dessas moléculas quebrando as ligações peptídicas entre alguns aminoácidos, é específica para certos pontos da proteína, e, portanto, não ocorre uma digestão completa. Os produtos dessa quebra são cadeias de aminoácidos relativamente longas, como as peptonas, mas há aminoácidos que se libertam completamente como a fenilalanina, o triptofano e a tirosina principalmente.
A deficiência de pepsina no organismo pode ser causada principalmente por problemas fisiológicos, como a acloridria , deficiência na secreção ácida no estômago, ou resultantes da utilização de certos medicamentos que inibem a secreção de ácido clorídrico no estômago, como os anti-ulcerativos e os antiácidos. Problemas fisiológicos deste tipo impossibilita a conversão do pepsinogénio em pepsina. Esta deficiência acarreta em uma má digestão proteica, facto que pode fazer aumento o tempo de digestão e causar acumulação de proteínas no intestino, causando fermentação (pelas bactérias presentes no intestino) e deficiência na absorção de aminoácidos pelo organismo.
CURIOSIDADES: A pepsina pode ser extraída do estômago de suínos e bovinos e utilizada pela indústria alimentícia na produção de coagulantes de leite e amaciadores de carne. O nome “Pepsi” (marca de refrigerantes) tem esse nome por ter pepsina na sua constituição e, inicialmente, era utilizada como um medicamento para curar a dispepsia.
Trabalho realizado por:
Brayan Freitas
Brayan Freitas
Diogo Fernandes
Mariana Gonçalves
Miguel Pinto
.